유기 화합물은 탄소를 기반으로 하는 화학 물질로, 생명체의 기본 구성 요소이자 다양한 산업의 핵심 재료입니다. 이번 포스팅에서는 유기 화합물의 정의, 구조적 특징, 주요 성질, 그리고 실생활에서의 응용을 자세히 다룹니다.
유기 화합물의 구조와 성질

1. 유기 화합물의 정의
1.1 유기 화합물이란?
유기 화합물은 탄소 원자를 기본 골격으로 하며, 수소, 산소, 질소, 황, 할로젠 등의 원소와 결합하는 화합물을 말합니다.
1.2 특징
• 탄소 원자는 4개의 결합을 형성하여 다양한 구조(사슬형, 고리형, 입체형)를 이룹니다.
• 대부분 공유 결합을 형성하며, 물리적·화학적 특성이 다양합니다.
2. 유기 화합물의 구조
2.1 구조적 분류
| 1. 직쇄 구조-탄소가 직선으로 연결된 형태 | 메탄($CH_4$) 에탄($C_2H_6$)  |
| 2. 고리형 구조-탄소 원자가 고리를 이룬 구조 | 사이클로헥산($C_6H_{12}$) |
| 3. 방향족 화합물-벤젠 고리와 같은 특수 구조 | 벤젠($C_6H_6$) |
2.2 이성질체
| 1. 구조 이성질체 동일 분자식이지만 원자의 배열이 다른 화합물 |
$C_4H_{10}$ 부탄과 이소부탄 |
| 2. 입체 이성질체 3차원 공간에서 배치가 다른 화합물 |
$C_2H_2Cl_2$의 시스-트랜스 이성질체 |
3. 유기 화합물의 주요 성질
3.1 물리적 성질
• 대부분 공유 결합으로 구성되어 끓는점과 녹는점이 비교적 낮습니다.
• 극성 여부에 따라 물에 대한 용해도가 결정됩니다.
3.2 화학적 성질
1. 연소: 산소와 반응하여 이산화탄소와 물을 생성.
예: $CH_4 + 2O_2 \to CO_2 + 2H_2O$
2. 치환 반응: 한 원자가 다른 원자로 대체되는 반응.
예: 할로젠화 알케인에서의 치환
3. 첨가 반응: 불포화 탄화수소가 다른 원자와 결합.
예: 에텐($C_2H_4$)의 수소 첨가
4. 유기 화합물의 실생활 응용
4.1 플라스틱과 고분자
• 유기 화합물은 플라스틱, 합성 섬유, 고무의 기본 재료로 사용됩니다.
예: 폴리에틸렌$(C_2H_4)_n$: 포장재
4.2 의약품
• 대부분의 약물은 유기 화합물로 구성되어 있습니다.
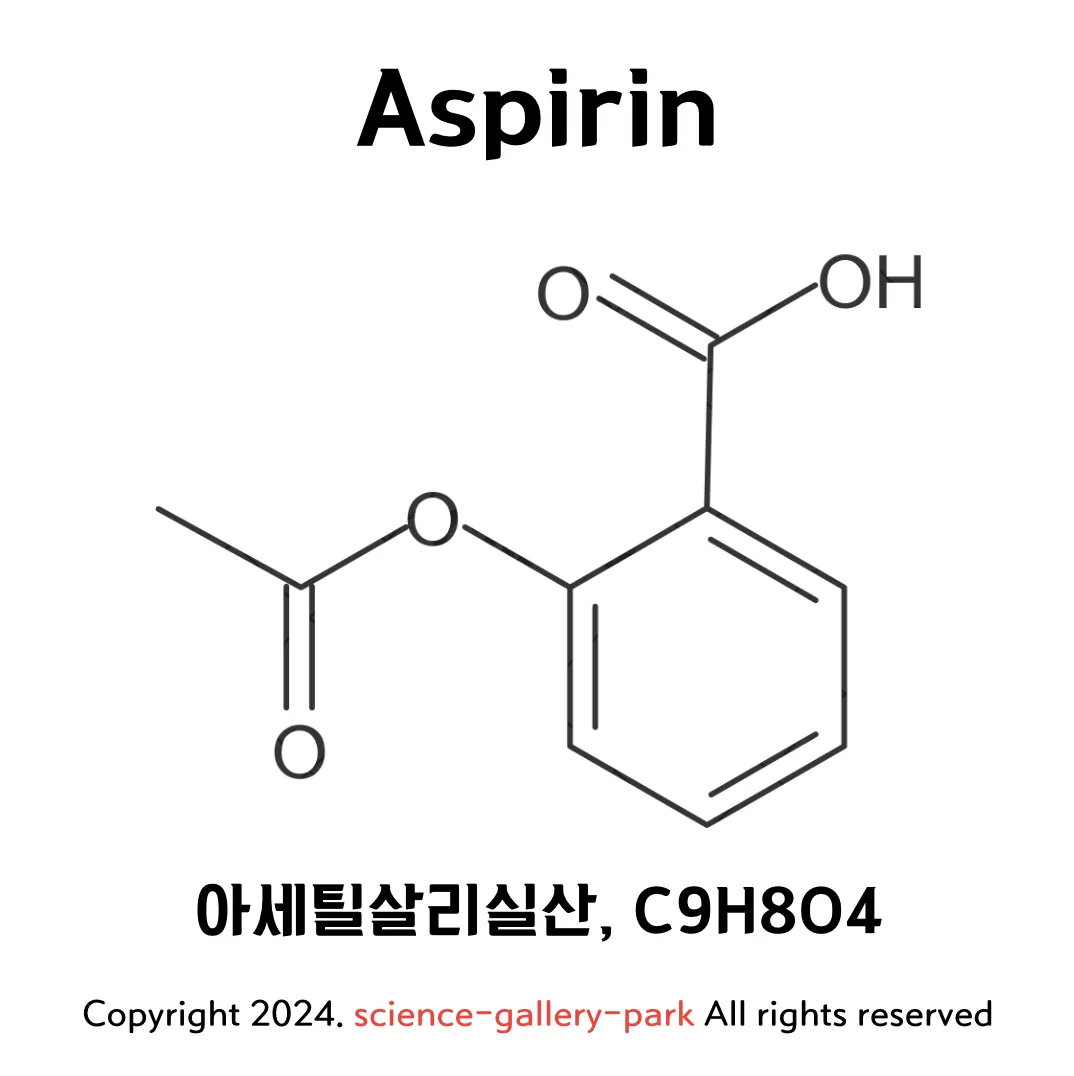
예: 아스피린(아세틸살리실산, $C_9H_8O_4$)
4.3 화장품과 세제
• 화장품과 세제는 계면활성제와 같은 유기 화합물로 이루어져 있습니다.
예: 소듐라우릴설페이트($C_{12}H_{25}SO_4Na$)
4.4 에너지
• 탄화수소는 연료로 사용됩니다.
예: 메탄($CH_4$), 부탄($C_4H_{10}$)
4.5 농업
• 살충제, 비료는 유기 화합물로 제조됩니다.
예: 유기인계 살충제($C_3H_9O_4P$)
자주 묻는 질문 (FAQs)
1. 유기 화합물이란 무엇인가요?
탄소를 기본 골격으로 하고, 다양한 원소와 결합한 화합물입니다.
2. 유기 화합물은 물에 녹나요?
극성을 가진 유기 화합물(예: 알코올)은 물에 잘 녹지만, 비극성 화합물(예: 탄화수소)은 잘 녹지 않습니다.
3. 유기 화합물은 어떻게 분류되나요?
직쇄 구조, 고리형 구조, 방향족 화합물 등으로 분류됩니다.
4. 유기 화합물의 주요 응용 분야는?
플라스틱, 의약품, 화장품, 연료 등에서 사용됩니다.
5. 유기 화합물의 반응에는 무엇이 있나요?
연소, 치환 반응, 첨가 반응 등이 있습니다.






 }
}